3D動畫帶你了解CRISPR-Cas9基因編輯(張鋒參與製作的哦)">
 來源:藥明康德▎藥明康德/編輯我們體內的每一個細胞都包含有一套基因組,超過2萬個基因、30億個DNA「字母」。DNA由兩股單鏈組成雙螺旋結構,它們由一種簡單的配對規則連接在一起:A與T配對,G與C配對。我們的基因決定了個體和物種。基因對健康也有深遠的影響。得益於DNA測序技術的發展,研究者們已經確定了成千上萬個與疾病有關的基因。為了理解基因的工作原理,研究者們需要找到控制它們的方法。改變活體動物基因並不容易,但最近,一種新方法出現了——它有希望極大地改進我們編輯任何生物DNA的能力,包括人類。CRISPR技術是以細菌保護自身不受病毒感染的系統為基礎。當細菌檢測到病毒的DNA時,它會生產出兩種較短的RNA。其中一種RNA包含與入侵病毒相對應的片段。這兩種RNA與一個蛋白質一起組成了一個復合體,叫做Cas9。Cas9是一種核酸酶,這是一種酶能夠切斷DNA。當相符的片段,也就是所謂的嚮導RNA,在病毒體內找到它的目標時,Cas9就會切下目標DNA,消滅病毒。過去的幾年裡,研究這個系統的科學家意識到,它可以被改造。這樣,不僅可以切斷病毒DNA,並且可以精確地針對所有DNA。不管它們位於什麼位置,只需要改造一下嚮導RNA與想要的目標相符合就行。這不僅可以在試管里完成,還可以在活體細胞的細胞核內進行。一旦進入了細胞核,這個復合體就會鎖定一段短序列,Cas9就會解開DNA,使其與目標RNA相匹配。配對完成後,Cas9就會使用兩個微小的分子剪刀來剪下DNA。這個過程中,細胞會試着修復剪下的部分,但修復過程很容易出錯,導致了使基因失效的變異,讓研究者能得以理解它的功能。這些變異是隨機的。不過,有時研究者需要更精確的編輯。比如說,用一個健康基因來取代一個變異的基因。可以添加一段攜帶有預期序列的DNA,一旦CRISPR系統的剪切完成,這個DNA模板能與剪切端頭配對,重新組合或用新版代替原有序列。這些都可以在培養細胞中完成,包括幹細胞。幹細胞可以分化為許多不同種類的細胞,也可以在受精卵上進行,創造出靶向變異的轉基因動物。與過去的方法不同,CRISPR可以同時針對多個基因靶向,這在研究複雜的人類疾病上是一個巨大的進步。它們不是只針對一個變異而是許多基因一起工作。這個方法正在飛速發展,將在基礎研究中大有用處,比如藥物開發和農業,也許最終將用在罹患遺傳疾病的患者身上。
來源:藥明康德▎藥明康德/編輯我們體內的每一個細胞都包含有一套基因組,超過2萬個基因、30億個DNA「字母」。DNA由兩股單鏈組成雙螺旋結構,它們由一種簡單的配對規則連接在一起:A與T配對,G與C配對。我們的基因決定了個體和物種。基因對健康也有深遠的影響。得益於DNA測序技術的發展,研究者們已經確定了成千上萬個與疾病有關的基因。為了理解基因的工作原理,研究者們需要找到控制它們的方法。改變活體動物基因並不容易,但最近,一種新方法出現了——它有希望極大地改進我們編輯任何生物DNA的能力,包括人類。CRISPR技術是以細菌保護自身不受病毒感染的系統為基礎。當細菌檢測到病毒的DNA時,它會生產出兩種較短的RNA。其中一種RNA包含與入侵病毒相對應的片段。這兩種RNA與一個蛋白質一起組成了一個復合體,叫做Cas9。Cas9是一種核酸酶,這是一種酶能夠切斷DNA。當相符的片段,也就是所謂的嚮導RNA,在病毒體內找到它的目標時,Cas9就會切下目標DNA,消滅病毒。過去的幾年裡,研究這個系統的科學家意識到,它可以被改造。這樣,不僅可以切斷病毒DNA,並且可以精確地針對所有DNA。不管它們位於什麼位置,只需要改造一下嚮導RNA與想要的目標相符合就行。這不僅可以在試管里完成,還可以在活體細胞的細胞核內進行。一旦進入了細胞核,這個復合體就會鎖定一段短序列,Cas9就會解開DNA,使其與目標RNA相匹配。配對完成後,Cas9就會使用兩個微小的分子剪刀來剪下DNA。這個過程中,細胞會試着修復剪下的部分,但修復過程很容易出錯,導致了使基因失效的變異,讓研究者能得以理解它的功能。這些變異是隨機的。不過,有時研究者需要更精確的編輯。比如說,用一個健康基因來取代一個變異的基因。可以添加一段攜帶有預期序列的DNA,一旦CRISPR系統的剪切完成,這個DNA模板能與剪切端頭配對,重新組合或用新版代替原有序列。這些都可以在培養細胞中完成,包括幹細胞。幹細胞可以分化為許多不同種類的細胞,也可以在受精卵上進行,創造出靶向變異的轉基因動物。與過去的方法不同,CRISPR可以同時針對多個基因靶向,這在研究複雜的人類疾病上是一個巨大的進步。它們不是只針對一個變異而是許多基因一起工作。這個方法正在飛速發展,將在基礎研究中大有用處,比如藥物開發和農業,也許最終將用在罹患遺傳疾病的患者身上。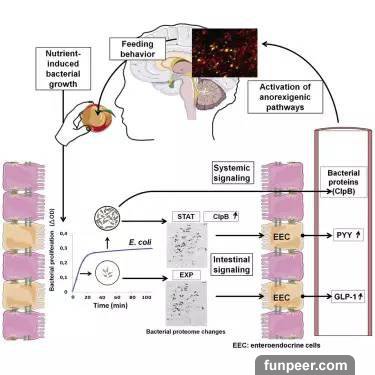 是不是感覺吃飽飯以後,肚子裡就沒地方再裝下其他食物了?最新研究發現這可能是腸道細菌在發揮作用。來自法國的科學家發現餐後20分鐘時間內腸道菌群會產生一些蛋白抑制食慾,相關研究結果發表在國際學術期刊cell metabolism 上 。研究人員還發現將這些細菌蛋白注入小鼠和大鼠體內,能夠作用於腦部神經元導致食慾受到抑制,這表明腸道細菌可能幫助我們調節了進食時間以及飯量。研究人員首次發現腸道共生的大腸桿菌"吃飽了"以後會產生一些細菌蛋白,這些細菌蛋白能夠影響腸腦軸信號分子的釋放(比如GLP-1以及PYY),並激活腦部的食慾調控神經元。研究人員表示,目前有許多關於不同病理條件下腸道菌群組成的研究,但是他們並沒有對這些關聯背後的機制進行深入探討,而這項研究表明大腸桿菌產生的細菌蛋白參與了機體用於調節飽腹感的信號途徑,現在我們進一步了解腸道菌群的改變如何影響生理機能。在這項研究中,研究人員發現進食20分鐘之後,腸道內的大腸桿菌會合成一些與進食之前不同的蛋白。而20分鐘似乎也是一個人餐後開始產生飽腹感並感覺到厭倦所需要的時間。研究人員對這一發現感到非常興奮,於是他們開始對餐前和餐後的細菌蛋白進行分析。他們發現將進食後產生的小劑量細菌蛋白注入實驗動物體內可以抑制飢餓以及自由進食狀態下大鼠和小鼠的食物攝取。進一步分析發現餐後產生的細菌蛋白能夠刺激PYY(一種與飽腹感形成有關的激素)的釋放,然而飢餓狀態下的細菌蛋白並不會產生這種現象。研究人員隨後又檢測了一種存在於血液中的餐後細菌蛋白ClpB。雖然這種蛋白在小鼠和大鼠血液中的水平在餐後20分鐘內沒有發生改變,但是它與糞便中的ClpB DNA含量具有相關性,這表明ClpB可能在腸道細菌組成與宿主食慾調控之間建立了聯繫。研究人員還發現ClpB能夠促進食慾抑制性神經元的激活。但其他大腸桿菌蛋白以及由其他細菌產生的蛋白在飢餓感與飽腹感調節方面的作用還沒有得到研究。綜上所述,這項研究表明細菌在生理情況下通過刺激多種參與食慾調節的激素表達參與食慾調節,除此之外,研究人員還表示腸道菌群產生的蛋白可以長期存在於血液中,調節腦部的信號途徑。
是不是感覺吃飽飯以後,肚子裡就沒地方再裝下其他食物了?最新研究發現這可能是腸道細菌在發揮作用。來自法國的科學家發現餐後20分鐘時間內腸道菌群會產生一些蛋白抑制食慾,相關研究結果發表在國際學術期刊cell metabolism 上 。研究人員還發現將這些細菌蛋白注入小鼠和大鼠體內,能夠作用於腦部神經元導致食慾受到抑制,這表明腸道細菌可能幫助我們調節了進食時間以及飯量。研究人員首次發現腸道共生的大腸桿菌"吃飽了"以後會產生一些細菌蛋白,這些細菌蛋白能夠影響腸腦軸信號分子的釋放(比如GLP-1以及PYY),並激活腦部的食慾調控神經元。研究人員表示,目前有許多關於不同病理條件下腸道菌群組成的研究,但是他們並沒有對這些關聯背後的機制進行深入探討,而這項研究表明大腸桿菌產生的細菌蛋白參與了機體用於調節飽腹感的信號途徑,現在我們進一步了解腸道菌群的改變如何影響生理機能。在這項研究中,研究人員發現進食20分鐘之後,腸道內的大腸桿菌會合成一些與進食之前不同的蛋白。而20分鐘似乎也是一個人餐後開始產生飽腹感並感覺到厭倦所需要的時間。研究人員對這一發現感到非常興奮,於是他們開始對餐前和餐後的細菌蛋白進行分析。他們發現將進食後產生的小劑量細菌蛋白注入實驗動物體內可以抑制飢餓以及自由進食狀態下大鼠和小鼠的食物攝取。進一步分析發現餐後產生的細菌蛋白能夠刺激PYY(一種與飽腹感形成有關的激素)的釋放,然而飢餓狀態下的細菌蛋白並不會產生這種現象。研究人員隨後又檢測了一種存在於血液中的餐後細菌蛋白ClpB。雖然這種蛋白在小鼠和大鼠血液中的水平在餐後20分鐘內沒有發生改變,但是它與糞便中的ClpB DNA含量具有相關性,這表明ClpB可能在腸道細菌組成與宿主食慾調控之間建立了聯繫。研究人員還發現ClpB能夠促進食慾抑制性神經元的激活。但其他大腸桿菌蛋白以及由其他細菌產生的蛋白在飢餓感與飽腹感調節方面的作用還沒有得到研究。綜上所述,這項研究表明細菌在生理情況下通過刺激多種參與食慾調節的激素表達參與食慾調節,除此之外,研究人員還表示腸道菌群產生的蛋白可以長期存在於血液中,調節腦部的信號途徑。 繼本月中旬獲得美國FDA批准之後,瑞士製藥巨頭羅氏(Roche)開發的一款口服靶向抗癌新藥Cotellic(cobimetinib)近日在歐盟也傳來喜訊,歐盟委員會(EC)已批准Cotellic聯合羅氏自身已上市的抗癌藥Zelboraf(vemurafenib,威羅菲尼),用於BRAF V600突變陽性、不可切除性或轉移性黑色素瘤成人患者的治療。(相關閱讀:羅氏黑色素瘤新藥Cotellic獲FDA批准)Cotellic的獲批,主要基於關鍵III期coBRIM研究的數據,該研究是一項國際、隨機、雙盲、安慰劑對照III期研究,在495例先前未經治療的、攜帶BRAF V600突變的不可切除性局部晚期或轉移性黑色素瘤患者中開展,調查了Cotellic(60mg劑量,每天一次)聯合Zelboraf(960mg劑量,每天2次)的療效和安全性。數據顯示,與Zelboraf+安慰劑治療組相比,Cotellic+Zelboraf聯合治療組疾病惡化或死亡風險顯著降低,無進展生存期(中位PFS:12.3個月vs 7.2 個月,p<0.001)顯著延長,客觀緩解率(ORR:70% vs 50%,p<0.001)、完全緩解率(16% vs 11%)更高。近日,羅氏在2015年黑色素瘤研究學會(SMR)國際會議上公布了coBRIM研究的新數據。數據顯示,與Zelboraf+安慰劑治療組相比,Cotellic+Zelboraf聯合治療組死亡風險顯著降低30%(中位總生存期OS:22.3個月 vs 17.4個月,p=0.005)。這些數據進一步加強了Cotellic+Zelboraf組合針對BRAF V600突變陽性晚期黑色素瘤的臨床療效,尤其是患者總生存期方面。(相關閱讀:羅氏組合療法Cotellic/Zelboraf大幅改善BRAF突變陽性晚期黑色素瘤總生存期)cobimetinib是一種口服小分子MEK抑制劑,MEK是一種蛋白激酶,是RAS-RAF-MEK-ERK信號通路的一部分,該通路可促進細胞的分裂和存活,在人類癌症(包括黑色素瘤)中往往處於激活狀態。cobimetinib旨在選擇性阻斷MEK蛋白的活性,從而阻斷其下游的信號通路傳導。目前,羅氏也正在調查cobimetinib聯合其他藥物(包括免疫療法)用於多種類型腫瘤的治療潛力,包括非小細胞肺癌(NSCLC)、結腸癌、三陰乳腺癌和黑色素瘤。
繼本月中旬獲得美國FDA批准之後,瑞士製藥巨頭羅氏(Roche)開發的一款口服靶向抗癌新藥Cotellic(cobimetinib)近日在歐盟也傳來喜訊,歐盟委員會(EC)已批准Cotellic聯合羅氏自身已上市的抗癌藥Zelboraf(vemurafenib,威羅菲尼),用於BRAF V600突變陽性、不可切除性或轉移性黑色素瘤成人患者的治療。(相關閱讀:羅氏黑色素瘤新藥Cotellic獲FDA批准)Cotellic的獲批,主要基於關鍵III期coBRIM研究的數據,該研究是一項國際、隨機、雙盲、安慰劑對照III期研究,在495例先前未經治療的、攜帶BRAF V600突變的不可切除性局部晚期或轉移性黑色素瘤患者中開展,調查了Cotellic(60mg劑量,每天一次)聯合Zelboraf(960mg劑量,每天2次)的療效和安全性。數據顯示,與Zelboraf+安慰劑治療組相比,Cotellic+Zelboraf聯合治療組疾病惡化或死亡風險顯著降低,無進展生存期(中位PFS:12.3個月vs 7.2 個月,p<0.001)顯著延長,客觀緩解率(ORR:70% vs 50%,p<0.001)、完全緩解率(16% vs 11%)更高。近日,羅氏在2015年黑色素瘤研究學會(SMR)國際會議上公布了coBRIM研究的新數據。數據顯示,與Zelboraf+安慰劑治療組相比,Cotellic+Zelboraf聯合治療組死亡風險顯著降低30%(中位總生存期OS:22.3個月 vs 17.4個月,p=0.005)。這些數據進一步加強了Cotellic+Zelboraf組合針對BRAF V600突變陽性晚期黑色素瘤的臨床療效,尤其是患者總生存期方面。(相關閱讀:羅氏組合療法Cotellic/Zelboraf大幅改善BRAF突變陽性晚期黑色素瘤總生存期)cobimetinib是一種口服小分子MEK抑制劑,MEK是一種蛋白激酶,是RAS-RAF-MEK-ERK信號通路的一部分,該通路可促進細胞的分裂和存活,在人類癌症(包括黑色素瘤)中往往處於激活狀態。cobimetinib旨在選擇性阻斷MEK蛋白的活性,從而阻斷其下游的信號通路傳導。目前,羅氏也正在調查cobimetinib聯合其他藥物(包括免疫療法)用於多種類型腫瘤的治療潛力,包括非小細胞肺癌(NSCLC)、結腸癌、三陰乳腺癌和黑色素瘤。[圖擷取自網路,如有疑問請私訊]
|
本篇 |
不想錯過? 請追蹤FB專頁! |
| 喜歡這篇嗎?快分享吧! |
相關文章
快樂生活一點通
























